Coladores moleculares
Eric Edmundo Hernández Domínguez1,2
Todos hemos estado en la cocina de nuestra casa buscando en algún momento el colador para tratar de quitar pedacitos de servilleta o algunas basurillas que le ha caído a nuestra bebida favorita o para retirar el bagazo de nuestro jugo. Este proceso tan cotidiano podemos decir que es la base de muchas técnicas de laboratorio usadas por los científicos para realizar sus investigaciones.
Grosso modo, cuando empleamos el colador de nuestra casa lo que estamos realizando, es separar dos o más sustancias que pueden ser sólidas y/o líquidas (al separar las verduras del agua de cocción), o de diferentes tamaños, (por ejemplo, al cernir la harina para separar las partículas gruesas de las finas con el propósito de que no se formen grumos en la masa). Por otro lado, en el laboratorio podemos usar este mismo colador o hasta un papel filtro de cafetera, para realizar algún experimento en donde queramos separar diferentes sustancias. Un área de investigación en donde se recurre frecuentemente a este tipo de técnicas es en el área de las proteínas. Las proteínas son macromoléculas constituidas por uniones de otras moléculas conocidas como aminoácidos y que formaran una estructura tridimensional final (slider). Para estudiar y conocer la función de una proteína es necesario que se encuentre solita es decir separarla de otras proteínas, otras moléculas en si de todo lo que conforma a una célula. Las proteínas son moléculas extremadamente pequeñas y cada organismo contiene una gran cantidad de proteínas que cuentan con diferente forma y tamaño. Si una proteína fuera del tamaño de una moneda de un peso mexicano y sacáramos todas las proteínas que constituye a un ser humano, nosotros mediríamos la distancia que hay de México a Chile; aproximadamente 7000 km). Parecería entonces un gran reto poder purificar una proteína de entre miles que existen, considerando que son moléculas con diferente tamaño y forma. Afortunadamente, existen diversos métodos que nos permiten separar las proteínas en el laboratorio, entre ellos podemos mencionar la ultrafiltración, la cromatografía liquida y la electroforesis.
En la electroforesis empleamos la corriente eléctrica para mover y hacer pasar las proteínas por un gel (una especie de malla tridimensional) donde las proteínas pequeñas avanzan más aprisa y las proteínas grandes se mueven muy despacio, logrando separarlas (Figura 2).
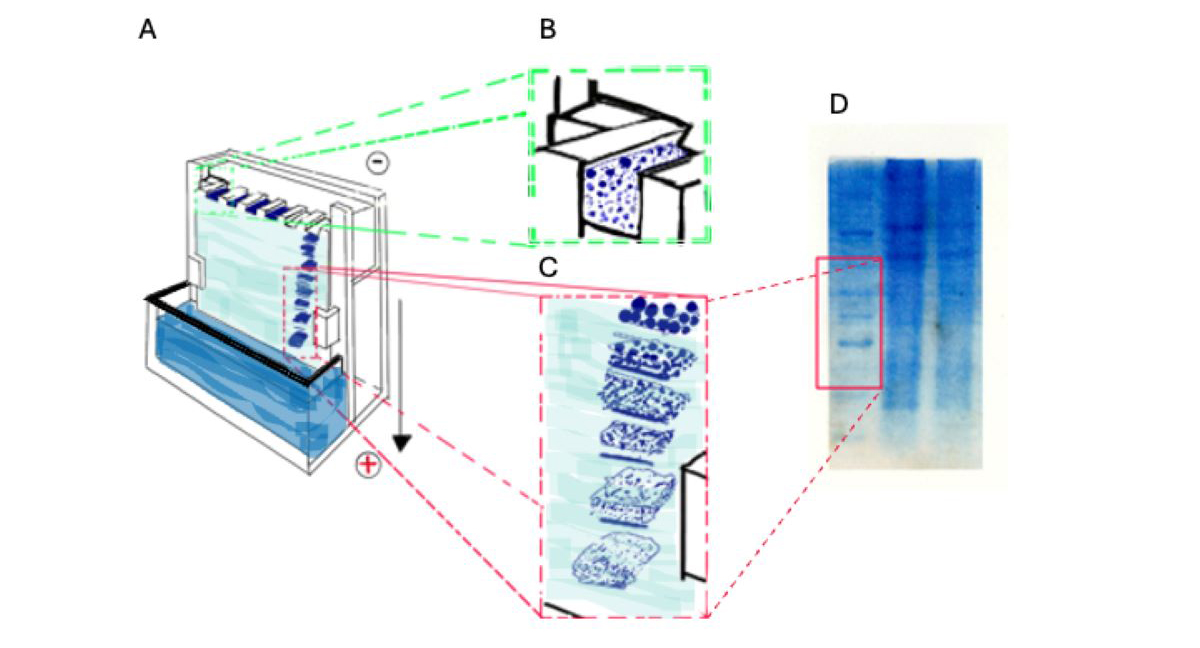
Fig. 2 Separación de proteínas por electroforesis. A. Equipo de electroforesis para separación de proteínas (adaptado de https://microbenotes.com/polyacrylamide-gel-electrophoresis-page/). B. Cámara superior del equipo de electroforesis donde se coloca la mezcla de proteínas a separar. C. las proteínas se separan en sus diferentes tamaños. D. Separación por tamaños de una mezcla compleja de proteínas en el laboratorio. Las diferentes bandas corresponden a proteínas con diversos tamaños.
En la cromatografía liquida nos ayudamos de un soporte sólido contenido en un recipiente en forma de columna y que tiene partículas de un material con pequeños poros (invisibles para el ojo humano) y por donde pasa la muestra con ayuda de una bomba de líquidos. Las moléculas más grandes no pueden entrar en los poros del material por lo que salen de la columna rápidamente mientras que las moléculas pequeñas al entrar por los poros tardan más en recorrer toda la columna y salen al final (Figura 3B).
La ultrafiltración es un método de separación que requiere la ayuda de una membrana, en el cual se ejerce presión sobre un líquido y dado que la membrana tiene poros con un cierto tamaño solo las moléculas que quepan en ese poro (las más pequeñas) van a poder atravesarla (Figura 3B).
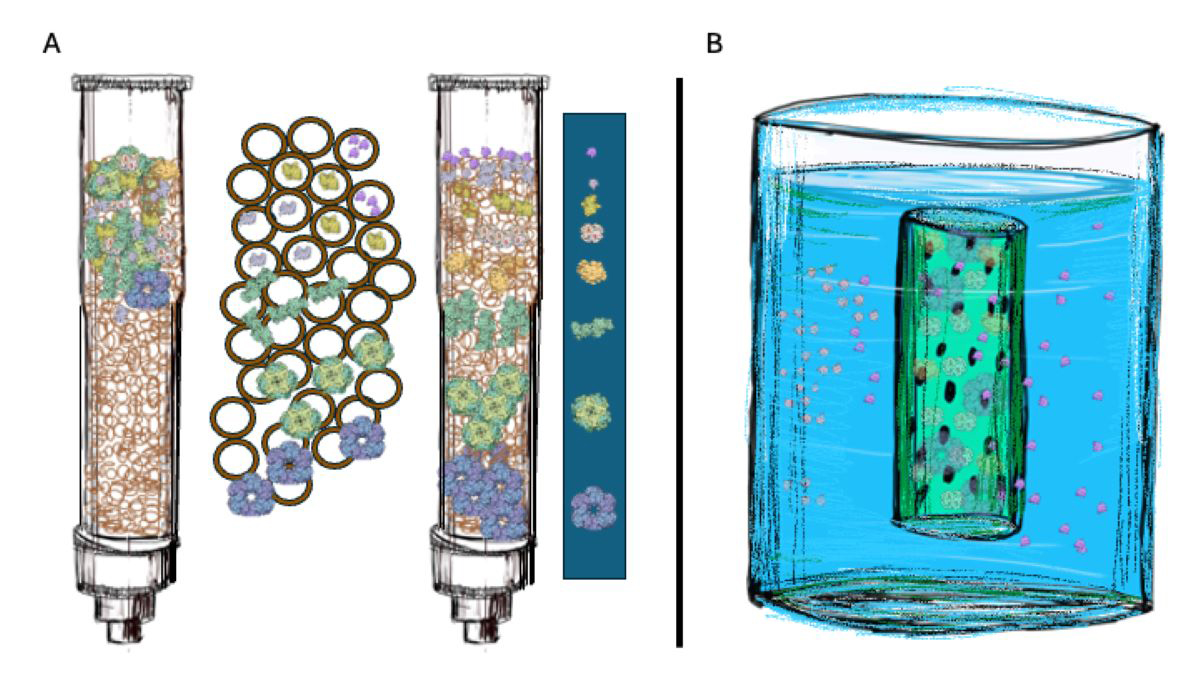
Fig 3. Separación de moléculas por los métodos de A. cromatografía y B. ultrafiltración con membrana. En la cromatografía las moléculas pequeñas entran dentro del soporte (esferas huecas de un polímero) por lo que tardan más en recorrer la columna. Por el otro lado, las proteínas grandes no pueden entrar en el soporte, por lo que tardan menos en recorrer la columna. En la ultrafiltración (también conocida como diálisis) las moléculas pequeñas pueden salir, pero las grandes no. Los dibujos de las proteínas fueron tomadas del Protein Data Bank https://cdn.rcsb.org/pdb101/molecular-machinery/
Finalmente, y para resaltar la importancia de los métodos de separación de las moléculas y su transcendencia para la vida, es de mencionar que los organismos los utilizan desde hace mucho tiempo, con una eficiencia y complejidad que hasta ahora es difícil de emular. Por ejemplo, está la función del riñón en donde se da la separación y la eliminación mediante la orina de sustancias de desechos producidas por las reacciones metabólicas de nuestras células. También, está el hígado que se encarga de separar una gran cantidad de moléculas de desecho como resultado del metabolismo celular.
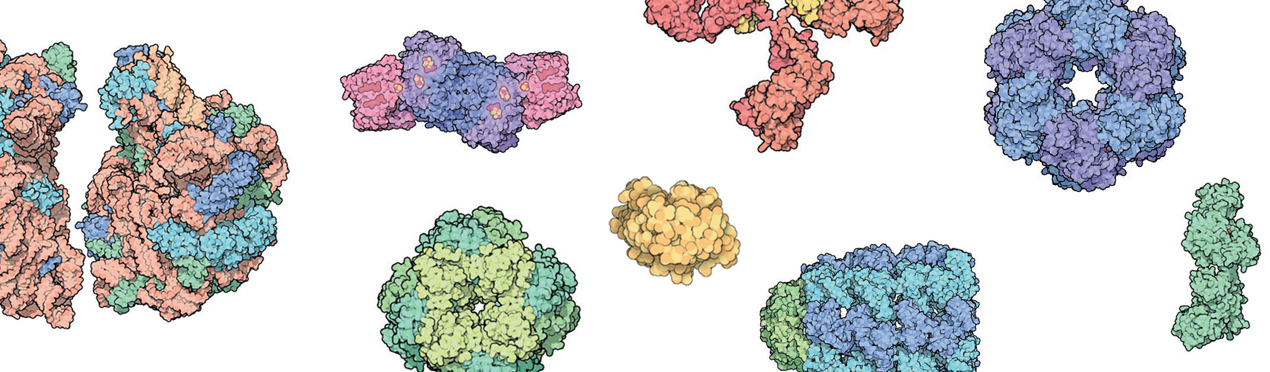
Slider: Comparación de estructuras de diversas proteínas donde se observa las formas y los tamaños relativas entre ellas. Las imágenes fueron tomadas de la página del Protein Data Bank https://cdn.rcsb.org/pdb101/molecular-machinery/
1 INSTITUTO DE ECOLOGÍA. RED DE ESTUDIOS MOLECULARES AVANZADOS. LABORATORIO DE PROTEÓMICA
2 INVESTIGADOR POR MÉXICO
