Del legado nuclear a la medicina de precisión: el resurgir de los radiofármacos
Daniel García-Arce1, Abraham Vidal Limón2, Myrna Luna Gutiérrez1 y Blanca Ocampo García1

En el corazón del Laboratorio Nacional de Oak Ridge, en Tennessee, un edificio de apariencia modesta guarda una historia que enlaza el pasado nuclear con la medicina del futuro.
El edificio 7920, una estructura encalada de la era de la Guerra Fría construida en 1966, fue concebido en la visión del físico Glenn Seaborg, descubridor del plutonio durante el Proyecto Manhattan. Lo que alguna vez fue un espacio dedicado a la creación de nuevos elementos químicos hoy alberga una “granja de torio”, una instalación donde se cultiva, por así decirlo, una fuente singular de esperanza contra el cáncer.
Dentro de sus muros de hormigón reforzado y protegidos por gruesos paneles de plomo, los técnicos utilizan brazos robóticos para “ordeñar” unos tubos de ensayo que contienen una sustancia amarillenta compuesta por torio-229, un isótopo radiactivo (radionúclido). De esta materia se obtiene en cantidades minúsculas pero valiosísimas el actinio-225 (Ac-225, 225Ac), un raro radioisótopo que hoy encabeza la nueva generación de tratamientos oncológicos. Su demanda es tan alta que la escasez del material ha detenido más de un ensayo clínico.
El actinio-225 representa la vanguardia de una nueva ola de interés en los radiofármacos, moléculas que combinan la potencia destructiva de la radiactividad con la precisión de la biotecnología molecular. Estos fármacos actúan como misiles dirigidos: transportan los isótopos radiactivos directamente hasta las células cancerosas, minimizando el daño a los tejidos sanos. A diferencia de la quimioterapia tradicional, que afecta indiscriminadamente a las células de rápida división, los radiofármacos ofrecen una alternativa más precisa y con menos efectos secundarios.
Aunque la terapia con radioisótopos no es nueva, una combinación de avances tecnológicos ha propiciado un auge sin precedentes. El concepto fundamental de utilizar átomos radiactivos para destruir células enfermas desde dentro tiene décadas con nosotros. Sin embargo, las mejoras recientes en los tres componentes básicos de los radiofármacos han revolucionado su diseño y eficacia: la fuente de radiación, los acarreadores más precisos hacia sus blancos moleculares y la química de coordinación.
Durante años, los oncólogos contaron con un número limitado de isótopos, pero hoy los investigadores exploran nuevas opciones, como225 Ac, capaz de emitir radiación con diferentes intensidades y tiempos de acción. Paralelamente, el segundo componente implica un frente de innovación, ya que se centra en los elementos acarreadores de precisión: anticuerpos, péptidos y moléculas pequeñas que actúan como guías moleculares, dirigiendo la radiactividad hacia las células tumorales.
El tercer componente —los enlaces químicos que conectan el radionúclido con su molécula transportadora— también ha dejado de ser un mero detalle técnico. Estos enlazadores se están rediseñando para controlar la velocidad con que los radionúclidos se distribuyen y se eliminan del cuerpo, reduciendo los efectos secundarios y aumentando la eficacia terapéutica. Al combinar y ajustar estos tres elementos, los científicos están creando un verdadero arsenal de radiofármacos personalizados, capaces de atacar desde tumores hematológicos difusos, como la leucemia, hasta masas sólidas como los cánceres de mama o colon.
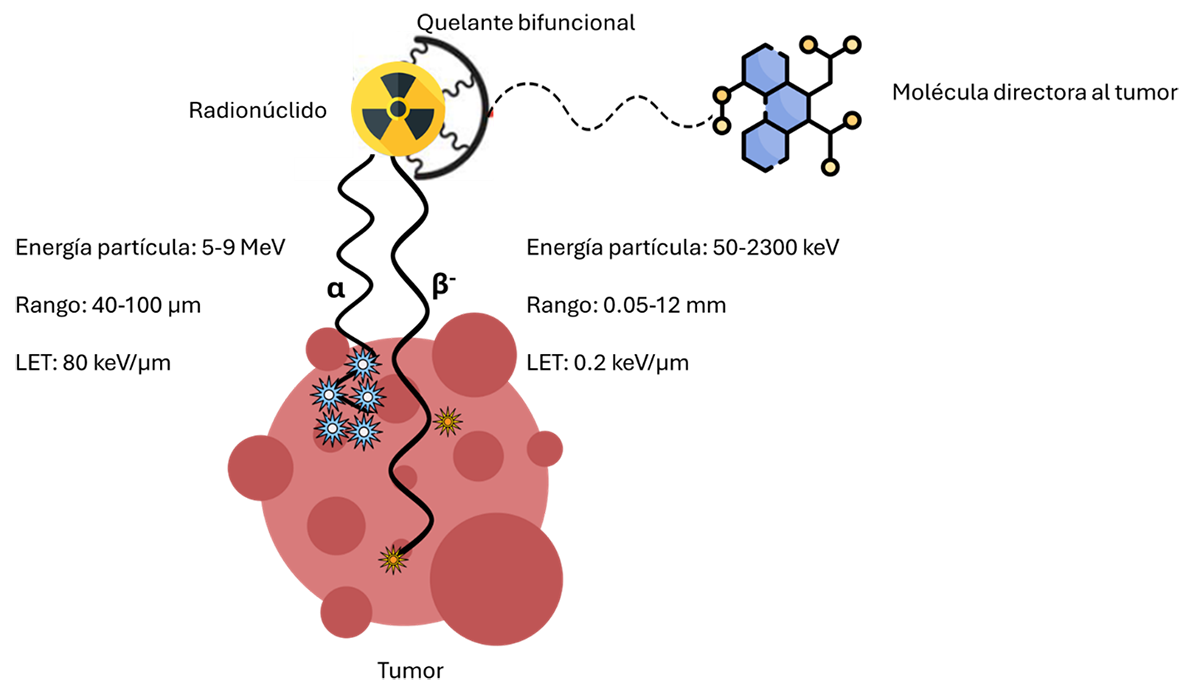
Diferencias en la emisión y alcance de partículas alfa y beta según el diseño molecular de radiofármacos para aplicaciones oncológicas
Una vieja idea que desentrañó los pasos a seguir: precisión, biología y química al servicio de la medicina
Pero las raíces de este campo se remontan mucho más allá. En 1941, el médico de Harvard Saul Hertz fue pionero en la idea de dirigir un isótopo radiactivo hacia un tejido específico. Su primer experimento consistió en administrar a un paciente un vaso de agua con yodo-131 radiactivo para tratar su enfermedad de Graves (causada por una tiroides hiperactiva). Hertz razonó que, dado que las células tiroideas absorben yodo para fabricar hormonas, el isótopo radiactivo se acumularía en ellas, destruyendo selectivamente las células hiperactivas. Los resultados fueron asombrosos: un contador Geiger detectó un aumento de radiación en el cuello del paciente, lo que confirmó que el yodo había alcanzado su objetivo, y los ensayos posteriores mostraron porcentajes de éxito cercanos al 80 %.
Casos de éxito y el salto hacia una nueva generación de radiofármacos
Durante décadas, los desafíos técnicos y regulatorios limitaron el progreso de los radiofármacos. Sin embargo, el panorama cambió de manera decisiva en 2017, cuando la Agencia Europea de Medicamentos (EMA) aprobó el uso de Lutathera para tratar tumores de origen neuroendocrino. El radiofármaco, conocido químicamente como 177Lu-DOTATATE, combina tres elementos clave:
- Lutecio-177, un radionúclido que emite partículas beta de alta energía;
- Un ligante molecular (DOTA) que recubre y engloba al radionúclido y
- Un péptido de cadena corta (TATE) que dirige el compuesto hacia los receptores de somatostatina específicos en los tumores neuroendocrinos gastrointestinales.
Al decaer, el núcleo radioactivo de lutecio-177 libera energía suficiente para destruir selectivamente las células tumorales, reduciendo el tamaño de los tumores con una precisión inédita. La Administración de Alimentos y Medicamentos (FDA) de Estados Unidos aprobó Lutathera en 2018, y en 2024 extendió su uso al tratamiento pediátrico, convirtiéndolo en el primer radiofármaco aprobado para niños. Los ensayos clínicos más recientes muestran que Lutathera prolonga la supervivencia libre de progresión tumoral en adultos en 23 meses.
Un segundo caso de éxito se registró en 2022, cuando la FDA aprobó Pluvicto, otro radiofármaco basado en lutecio-177, diseñado para tratar el cáncer de próstata metastásico. En sus ensayos más amplios, Pluvicto duplicó la mediana de supervivencia libre de progresión, alcanzando los 12 meses, una mejora significativa frente a las terapias convencionales. Estos resultados marcaron un antes y un después, como expresó Davi Cade, director médico de Telix Pharmaceuticals: “Eso abrió los ojos de todos y mostró que había algo allí”.
El éxito clínico y comercial de Lutathera y Pluvicto desató una verdadera carrera en el sector: en 2024, las fusiones y adquisiciones en el campo de los radiofármacos superaron los 9 mil millones de dólares, mientras las farmacéuticas compiten por desarrollar el próximo gran avance. Paradójicamente, la complejidad de producción y manejo de estos medicamentos actúa como una ventaja estratégica, dificultando la competencia directa y elevando el valor de la innovación.
Hasta ahora, la mayoría de los radiofármacos clínicamente aprobados se basan en emisores beta, como el lutecio-177, cuyos electrones de alta energía dañan el ADN de las células cancerosas a una escala de milímetros. Sin embargo, la atención se está desplazando hacia los emisores alfa, radionúclidos más potentes que expulsan pares de protones y neutrones. Su alcance es minúsculo —solo unas pocas capas celulares—, pero su impacto es devastador: en lugar de cortar una sola hebra del ADN, rompen la doble hélice completa, lo que dificulta cualquier intento de reparación celular.
A diferencia de los electrones beta, las partículas alfa son auténticos pesos pesados en el mundo atómico: paquetes compactos de dos protones y dos neutrones que viajan con el ímpetu de una bala microscópica, lo que las hace casi 8 000 veces más masivas que un electrón, generando una energía concentrada capaz de arrasar todo a su paso en distancias diminutas. A esto se le conoce como Transferencia Lineal de Energía (LET, por sus siglas en inglés): la cantidad de energía que una partícula deposita al recorrer la materia. Mientras un emisor beta tiene un LET relativamente bajo —su energía se dispersa a lo largo de varios milímetros de tejido—, una partícula alfa concentra una energía enorme, del orden de 80 a 100 keV por micrómetro recorrido, en un trayecto de apenas unas pocas células. En términos sencillos, un haz de partículas beta “quema” de forma difusa, mientras que una partícula alfa actúa como un bisturí microscópico capaz de destruir con precisión quirúrgica el ADN de una célula tumoral. Esa altísima densidad de energía es la clave de su poder terapéutico… y también del reto de controlarlo con seguridad.
“Los emisores alfa son como camiones Mack”, explica Thomas Hope, oncólogo radioterapeuta de la Universidad de California en San Francisco, aludiendo a su fuerza letal concentrada.
Un primer paso en esta dirección fue el radio-223, aprobado en 2013, que imita químicamente al calcio y se incorpora al hueso afectado por metástasis de cáncer de próstata. Aunque eficaz, también puede dañar la médula ósea. Por ello, la nueva generación de radiofármacos —basados en 225Ac y otros emisores alfa— busca una precisión mucho mayor, minimizando los efectos colaterales.
Figura 1. Diferencias en la emisión y alcance de partículas alfa y beta según el diseño molecular de radiofármacos para aplicaciones oncológicas.
Entre los desarrollos más prometedores figura RYZ101, un fármaco experimental desarrollado por RayzeBio, una startup de San Diego recientemente adquirida por Bristol Myers Squibb. Este radiofármaco utiliza el mismo sistema de reconocimiento molecular queLutathera, pero sustituye el lutecio-177 por el actinio-225, combinando así un blanco probado con una fuente de radiación mucho más potente.
Los primeros ensayos, dirigidos por Thomas Hope, se centran en pacientes cuyos tumores intestinales ya no responden a Lutathera. Los resultados iniciales son alentadores: los pacientes han tolerado bien el tratamiento, y la potencia adicional del actinio-225 parece potenciar la eliminación de células cancerosas resistentes. Los estudios de eficacia multicéntricos están en marcha, y se espera que los resultados definitivos estén disponibles el próximo año.
“Hay mucho optimismo y potencial aquí”, concluye Hope.
La precisión que nace en casa: México avanza hacia su propia medicina nuclear
En México, la historia de los radiofármacos también se escribe con empeño local. Desde el Laboratorio Nacional de Investigación y Desarrollo de Radiofármacos (LANIDER), con sede en el Instituto Nacional de Investigaciones Nucleares (ININ), se trabaja para transformar la energía nuclear en bienestar médico. Su misión es clara: generar conocimiento y tecnología radiofarmacéutica propia, capaz de atender las necesidades del país sin depender completamente del extranjero. En un campo donde los radionúclidos tienen vidas medias de apenas horas o días, contar con infraestructura nacional no solo es una cuestión de soberanía científica, sino también de oportunidad clínica: cada minuto cuenta entre la producción y la administración al paciente.

Precursores de Radiofármacos de reconocimiento molecular basados en péptidos y moléculas pequeñas. ININ
El impacto del LANIDER es tangible ya que abastece cerca del 70% de los radiofármacos utilizados en México, lo que permite la realización de más de 350 mil estudios médicos cada año y el suministro a más de un centenar de centros de medicina nuclear en México y Centroamérica. Más allá de las cifras, representa un cambio de paradigma: pasar de importar conocimiento a producirlo.
Los ensayos clínicos realizados en México con los radiofármacos 177Lu-iPSMA y 177Lu-Octreótido han demostrado que estos pueden mejorar la supervivencia global en pacientes con cánceres avanzados. Por ejemplo, los pacientes con cáncer de próstata resistente a la castración metastásico (CPRCm) tratados con 177Lu-iPSMA mostraron una supervivencia global de 21.7 meses. Del mismo modo, los pacientes con tumores neuroendocrinos (NET) tratados con 177Lu-DOTA-TOC mostraron una mediana de supervivencia libre de progresión de 34.7 meses y una supervivencia global de más de 44.2 meses.
En resumen, el uso de radiofármacos en México proporciona un marco sólido para la terapia personalizada y dirigida del cáncer, lo que conduce a tratamientos más eficaces, un alivio significativo del dolor y mejores tasas de supervivencia para los pacientes.En ese mismo horizonte se inscribe el trabajo de nuestro grupo de investigación, enfocado en el diseño y evaluación preclínica de radiofármacos dirigidos a blancos tumorales de alta relevancia, como la proteína activadora de fibroblastos (FAP) y el antígeno prostático específico de membrana (PSMA). Ambas moléculas representan puertas de entrada estratégicas al microambiente tumoral: la FAP se sobreexpresa en las células que rodean y nutren al tumor, mientras que el PSMA es característico de las células cancerosas de próstata. Al acoplarlas con emisores alfa como el actinio-225 o betas como el lutecio-177, estos radiofármacos —los llamados iFAP e iPSMA— pueden llevar la energía destructiva del núcleo directamente al corazón del cáncer, con alta precisión y selectividad.
Aquel primer destello de precisión atómica en medicina abrió el camino a lo que hoy se perfila como una revolución terapéutica, en la que la física nuclear, la biología molecular y la química médica convergen para diseñar tratamientos cada vez más específicos, potentes y seguros. Hoy,
cientos de ensayos clínicos exploran las aplicaciones terapéuticas de estos isótopos, señalando un renacimiento científico en un campo que durante décadas avanzó lentamente. Desde los laboratorios de física nuclear hasta las salas de oncología, el legado del átomo vuelve a ponerse al servicio de la vida.
Referencias
- Service, R. F. (2025). Pharma’s hot zone. Science, 390(6768), 17–21. https://doi.org/10.1126/science.aec7036
- https://fusionpharma.com/targeted-alpha-therapeutics/
- García Espinosa, V. (2014, 7 de noviembre). Desarrolan radiofármacos de tercer generación contra cáncer. La Jornada. https://www.jornada.com.mx/2014/11/07/ciencias/a02n1cie
- Laboratorio Nacional de Investigación y Desarrollo de Radiofármacos (Lanider) | Instituto Nacional de Investigaciones Nucleares | Gobierno | gob.mx https://www.gob.mx/inin/acciones-y-programas/laboratorio-nacional-de-investigacion-y-desarrollo-de-radiofarmacos-73381
